
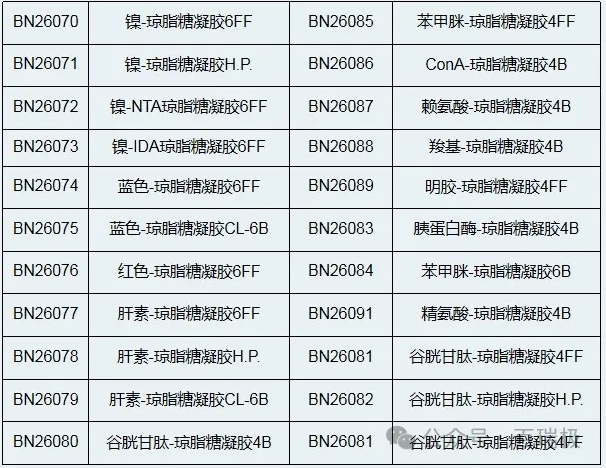
镍-琼脂糖凝胶FF主要用于纯化带组氨酸标签(His-Tag)的重组蛋白。纯化原理是利用重组蛋白组氨酸标签的咪唑环可与过渡金属Ni2+形成稳定的配位键,因此能特异、牢固、可逆地吸附于固定这些金属离子的基质,结合了His-Tag重组蛋白的镍-琼脂糖凝胶FF一般通过增加咪唑浓度进行竞争洗脱。
亲和层析是一种通过分子间的特异性识别和相互作用来分离纯化物质的层析方法。如酶与底物、抗原和抗体之间专一的相互作用等。将其一作为配基固定在填料上,就可以从初始样品中吸附相应的生物分子,然后通过合适的洗脱将其解离达到纯化的目的。

离子交换层析是基于蛋白质和离子交换层析介质之间的电荷相互作用进行分离。离子交换层析介质通常带有正或负电荷,吸附带有相反电荷的蛋白质。通过调整缓冲液的离子浓度或pH值,可以改变蛋白质与介质的结合强度,实现不同蛋白质的分离。
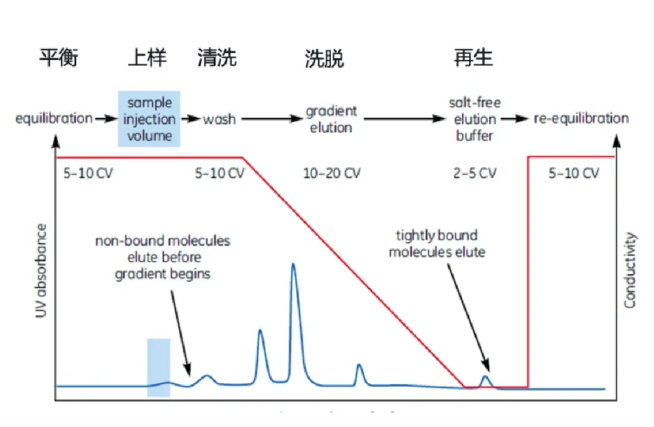
疏水层析(HIC)是一种液相吸附层析,它是依据生物分子之间的疏水性的差别来进行分离的。固定相由非极性物质(如烃类、苯基等)组成的层析,非极性分子间或分子的非极性基团间具有吸引力,不同分子的非极性基团与固定相的非极性物质结合的强弱不同,从而达到分离。该方法多用于蛋白质的分析和分离。